クシバタンポポや、ヤマザトタンポポなどは32本で4倍体(2n=4X=32)、シロバナタンポポは40本で5倍体(2n=5x=40)です。外来種には3倍体と4倍体があります。
2倍体種のタンポポは花粉の大きさが均一で、その他の高次倍数体(3、4、5倍体)は大きさが不均一(バラバラ)という特徴で区別することができるのですが、高次倍数体同士は染色体の本数を調べないと区別できません。
2010年春からタンポポの染色体観察をはじめました。今まで研究してきた在来種や外来種の染色体数を実際に自分の目で確かめてみようというわけです。
まずは参考書の「タンポポの観察と実験」をもとに、必要な試薬を買い集めて外来種タンポポの染色体からトライしました。
この時期でも種子を手に入れやすく、夏でも発芽する外来種タンポポ(3倍体:染色体数24本)の種子をガーゼを敷いたシャーレに並べ、乾かないように時々水を補給しながら野外へ放置。一週間くらいで緑色の双葉と根が出てきました。
この根っこを双葉ごと固定(アルコールなどで蛋白を変成させて、腐ったり形が変わったりしないようにする)してアルコールで保存しました。
その後、薄い塩酸溶液に数分漬けて、細胞をバラバラにします。
水洗いしてから、スライドグラスに載せ酢酸オルセイン液で染色体を染め、カバーグラスをかぶせてから指で押しつぶして観察です。

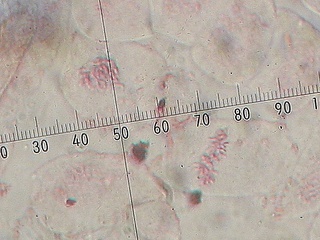
ピンク色のイトミミズ様に見えるのが染色体です(1000倍)しかし重なってしまって、一つひとつの染色体を区別して数える事ができません。そこで固定する前に8-ヒドロキシキノリンで染色体を凝縮させて観察することにしました。
| アカミタンポポ染色体 |
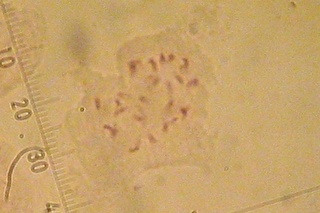

画像に黄色でマーキングしながら無理矢理カウントしてみると24本ありました。(右画像)アカミタンポポは3倍体なので基本の8本の3倍(8×3=24本)となります。
| セイヨウタンポポ染色体 |
弱拡大(100倍)では、染まりが悪くて失敗作に見えたのですが、ダメもとで1000倍で見てみると、良い細胞がたくさんありました。
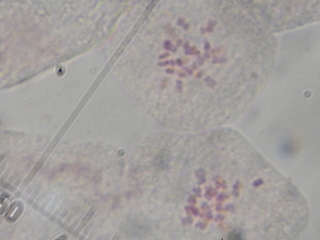
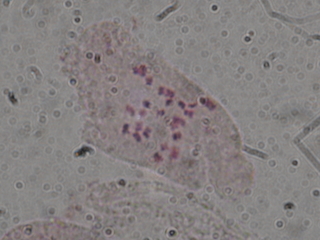
ちゃんと24本数える事が出来ました。
国内のセイヨウタンポポには4倍体と3倍体がありますが、今回観察できたのは染色体数24本の3倍体でした。(2n=3X=24)
| シロバナタンポポ染色体 |

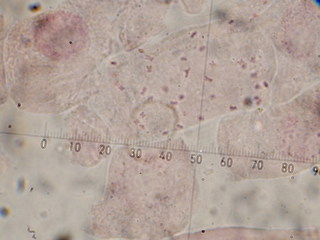
(秋鹿町産シロバナの染色体:1000倍視野で撮影したものをトリミング)
40本の染色体を確認できました。シロバナタンポポは5倍体(2n=5x=40)です。
| 緋紅蒲公英の染色体 |
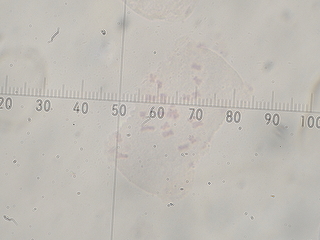
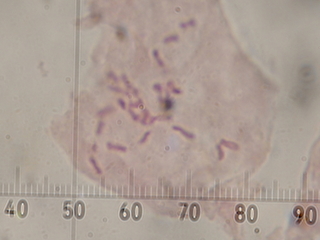
(緋紅蒲公英の染色体:1000倍視野で撮影したものをトリミング)
右は染色体の染まりが悪いですが、染色体がよく散らばっています。右はキノリン処理の時間が短いため染色体の凝縮が不十分で、一部重なって数えにくいのですが24本程度に見えます。今年入手した緋紅蒲公英2株だけの観察結果ではありますが、緋紅蒲公英(T.pseudoroseum)は3倍体(2n=3x=24)のようです。
| 染色体観察法について |
1)キノリン処理(0.002モル濃度の8-ヒドロキシキノリンに3時間程度漬ける)
キノリンは紡錘糸の形成を阻害したり、染色体を萎縮させる働きがあるので、観察しやすくする為の前処理。染色体数を数えやすくなる反面、核型の観察がしにくくなる。省略しても良いらしい。
富山大学の岩坪先生の手順に従って25℃で1.5時間程度おいた後、冷蔵庫で5時間ほど5℃においたところ、染色体がよく短縮した像が見られました。※0.002モル8-ヒドロキシキノリン溶液:8-ヒドロキシキノリン0.29gを1リットルの蒸留水で溶解して調製
2)固定(今回は70%アルコールを使用)と保存
タンパク質を変成させて腐敗などを防ぎ、長期間の保存ができる。固定はファーマー液(エチルアルコールと酢酸を3:1で混合)でも良い。長期の保存には70%アルコールが適しているそうです。
3)解離(60度に加温した1規定濃度の塩酸に数分間漬ける)
細胞同士の結合を弱くして細胞をバラバラにして、観察しやすくする。
4)染色(酢酸オルセインで染色体のみを染める)
解離した根の先端をスライドグラスにのせ、酢酸オルセインを数滴落として数分間染色したあと、気泡が入らないようにカバーグラスをかぶせ、指先やピンセットの先でおしつぶす。(カバーグラスを割らない程度に)。「カバーグラスがずれないように鉛筆の尻などで叩いて細胞を散らす」と本には書いてあります。
5)顕微鏡で観察。
根の先端付近の正方形に近い形の細胞を探し、分裂期で染色体が出現している細胞を探す。観察には1000倍程度の倍率が必要なので、油漬(スライドグラスと対物レンズの間にイマージョンオイルをつけて解像度を上げる)で観察しました。
Topページへ
